Nature Humaine (amocalypse)
Théorie>Formulaires>Grandeurs physiques
Première version: 29/08/2002
Dernière version: 2005-02-27
Grandeurs physiques
Voici ci-dessous plusieurs valeurs numériques des grandeurs physiques associées à différentes matières.
Sommaire de la page
-A -B -C -D -E -F -G -H -I -J -K -L -M -N -O -P -Q -R -S -T -U -V -W -X -Y -Z -
Acides-Bases :
Nom des acides les plus couramment employés en industrie:
H3O+ = acide
HCl = acide chlorhydrique
HClO = acide hypochloreux
H2SO4 = acide sulfurique
Air (composition de l') : Azote 78%; oxygène 21%, autres 1% (vapeur d'eau, CO2, gaz rares (argon, néon, hélium), impuretés).
Avogadro (nombre d') : NA = 6,0221367.1023 atomes(ou molécules) / mole
Base : Voir acides-bases
Capacité thermique massique : en J/(kg.K)
Substances |
Capacité thermique massique |
|
Liquides |
eau (liquide) |
4.185 5 |
Solides |
glace (eau solide) |
2.1 |
Gaz |
dihydrogène |
1.4 |
Célérité de la lumière dans le vide : c = 2,9972458.108 m/s
Changements de phase :
Processus |
Changements de phase |
Chaleur gagnée ou perdue par l'air (pression constante) |
|
|
depuis l'état |
vers l'état |
|
Condensation |
gaz |
liquide |
2500 J/g (600 cal/g) |
Déposition |
gaz |
solide |
2833 J/g (680 cal/g) |
Evaporation |
liquide |
gaz |
-2500 J/g (-600 cal/g) |
Solidification |
liquide |
solide |
333 J/g (80 cal/g) |
Fusion |
solide |
liquide |
-333 J/g (-80 cal/g) |
Sublimation |
solide |
gaz |
-2833 J/g (-680 cal/g) |
Charges électriques : exprimées en Coulomb (C).
électron: - 1,602 177 33.10-19 C (Coulomb)
proton: 1,602 177 33.10-19 C
neutron: 0 C
Classification périodique des éléments :
Liste des 46 éléments usuels par ordre alphabétique de leurs symboles dans la classification périodique :
Ag = Argent |
C = Carbone |
H = Hydrogène |
Mn = Manganèse |
Pt = Platine |
Liste des 46 éléments usuels par ordre alphabétique de leurs noms français :
Aluminium = Al |
Cadmium = Cd |
Fluor = F |
Molybdéne = Mo |
Plomb = Pb |
Z 1
X, par exemple H
A 1,008
avec X l'abréviation de l'élément (H pour hydrogène), Z le numéro
atomique (nombre de protons) et A la masse atomique (en uma). A-Z=nombre
neutrons.
Ia |
|
VIIIa |
|||||||||||||||
1 |
IIa |
|
IIIa |
IVa |
Va |
VIa |
VIIa |
2 |
|||||||||
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
||||||||||
11 |
12 |
IIIb |
IVb |
Vb |
VIb |
VIIb |
VIIIb |
Ib |
IIb |
13 |
14 |
15 |
16 |
17 |
18 |
||
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
31 |
32 |
33 |
34 |
35 |
18 |
37 |
38 |
39 |
40 |
41 |
42 |
43 |
44 |
45 |
46 |
47 |
48 |
49 |
50 |
51 |
52 |
53 |
54 |
55 |
56 |
57 |
72 |
73 |
74 |
75 |
76 |
77 |
78 |
79 |
80 |
81 |
82 |
83 |
84 |
85 |
86 |
87 |
88 |
89 |
104 |
105 |
106 |
107 |
108 |
109 |
110 |
111 |
112 |
|
|||||
* |
58 |
59 |
60 |
61 |
62 |
63 |
64 |
65 |
66 |
67 |
68 |
69 |
70 |
71 |
|||
90 |
91 |
92 |
93 |
94 |
95 |
96 |
97 |
98 |
99 |
100 |
101 |
102 |
103 |
||||
Chaleur : Voir température
Conditions de fonctionnement moteur : voir paramètres de fonctionnement moteur.
Conditions normales (en thermodynamique) : on place le corps dont on veut connaître les propriétés à la température de 0 °C, soit 273,15 °K, à la pression d'une atmosphère (1,013.105 N/m² => 1,013.105 Pa => 76 cm de mercure). On fait cela car les propriétés que l'on donnent varient en fonction de la température et de la pression.
Constantes physiques fondamentales:
Symbole |
Nom |
Valeur |
Unité |
α |
constante de structure fine |
7,297 353 08.10-3 |
- |
c |
Vitesse de la lumière |
299 792 458 |
m/s |
μ0 |
Perméabilité du vide |
12,566 370 614.10-7 |
N/A2 |
e |
Charge élémentaire |
1,602 177 33.10-19 |
C |
ε0 |
Permittivité du vide |
8,854 187 817.10-12 |
F/m |
eV |
electron-volt |
1,602 177 33.10-19 |
J |
F |
constante de Faraday |
96 485,309 |
C/mol |
φ0 |
flux magnétique |
2,067 834 61.10-15 |
Wb |
g |
constante de gravitation |
6,672 59.10-11 |
m3/(kg.s2) |
h |
constante de Planck |
6,626 075 5.10-34 |
J.s |
k |
constante de Boltzmann |
1,380 658.10-23 |
J/K |
me |
masse de l'électron (au repos) |
9,109 389 7.10-31 |
kg |
mp |
masse du proton (au repos) |
1,672 623 1.10-27 |
kg |
NA |
nombre d'Avogadro |
6,022 136 7.1023 |
mol-1 |
R |
const. molaire des gaz parfaits |
8.314 510 |
Pa.m3/(K.mol) ou J/(K.mol) |
R∞ |
constante de Rydberg |
10 973 731,534 |
m-1 |
σ |
constante de Stephan -Boltzmann |
5,670 51.10-8 |
W/(m2.K4) |
uma |
unité de masse atomique |
1,660 540 2.10-27 |
kg |
Densité :
C'est la masse volumique d'un corps comparée à celle de l'eau. Voir aussi
masse volumique.
Acier : 7,8
aluminium : 2,7
verre : 2,5
plastique entre 1 et 1,8
magnésium : 1,74
fibre de carbone : 1,8
Échelle décimétrique:
Giga (G) = 109
Mega (M) = 106
kilo (k) = 103
hecto (h) = 102
deca (da) = 101
deci (d) = 10-1
centi (c) =10-2
milli (m) = 10-3
micro (μ) = 10-6
nano (n) = 10-9
Énergie de dissociation : Voir Énergie de liaison.
Énergie d'ionisation : Énergie nécessaire pour extraire un électron d'un atome, d'un ion ou d'une molécule, sans lui communiquer de vitesse.
Énergie de liaison :
Elle est théoriquement égale à l'énergie de dissociation. Elle peut être exprimée en eV (énergie nécessaire pour séparer deux atomes), ou en J/mol (énergie pour séparer une mol de la molécule contenant les deux atomes à séparer).
Hydrogène moléculaire : 435,13 kJ/mol
Liaison hydrogène : 10 kJ/mol
Liaison covalente de l'eau : 492 kJ/mol ????
Énergie spécifique des carburants :
carburants liquides |
Energie spécifique |
Carburant gazeux |
CEMV |
Isooctane (référence) |
3 932 |
Isooctane (référence) |
3.42 |
Decane |
2 940 |
Méthane |
3.1 |
Hexane |
2 938 |
Ethane |
3.29 |
Butane |
2 961 |
Propane |
3.35 |
Cyclohexane |
2 942 |
Butane |
3.38 |
Hex-1-ène |
3 008 |
Decane |
3.44 |
Benzène |
3 032 |
But-1-ène |
3.5 |
Toluène |
3 011 |
Acétylène |
3.96 |
O et m-Xylène |
3 000 |
Cyclohexane |
3.42 |
Methanol |
3 086 |
Hex-1-ène |
3.47 |
Ethanol |
2 982 |
Methylcyclohexane |
3.42 |
Isopropanol |
2 945 |
Benzène |
3.515 |
Tertiobutanol |
2 915 |
Toluène |
3.505 |
Nitrométhane |
6 221 |
O-xylène |
3.5 |
Nitropropane |
5 010 |
1,2,4-Triméthylbenzène |
3.48 |
|
|
Méthanol |
3.38 |
|
|
Ethanol |
3.41 |
|
|
Isopropanol |
3.43 |
|
|
n-Butanol |
3.44 |
|
|
Nitrométhane |
6.03 |
|
|
Nitropropane |
4.06 |
|
|
Hydrogène |
2.92 |
|
|
Oxyde de carbone |
3.42 |
|
|
Ammoniac |
2.83 |
|
|
Essence commerciale |
3.46 |
1eV (électron-Volt) = 1,6.10-19 J. C'est une énergie au niveau de la molécule.
Faraday (constante de) : F = 96485,309 C/mole
Fréquences :
Spectre lumineux : Plus la longueur d'onde augmente, plus l'énergie du photon
et la fréquence diminuent.
Ultra-violets : Pour une longueur d'onde λ
inférieure à 0,4 μm, soit 7,5.105
Ghz.
Domaine visible : λ = 0,4 μm et λ = 0,8 μm, soit entre 7,5.105 Ghz et
3,7.105 Ghz.
Infra-rouges : Pour λ supérieure à 0,8 μm, soit 3,7.105 Ghz.
Fréquences de résonance :
h (constante de Planck) =6,62660755.10-34 J.s
Ionisation (Potentiel d') : Voir Potentiel d'ionisation.
Masse :
1 uma = 1.6604.10-27 kg
électron (au repos) : me =9,1093897.10-31 kg (au
repos) = 5,486.10-4 uma
neutron (au repos) : mn = 1,675.10-27 kg =
1,008665 uma
proton (au repos) : mp = 1,672 623 1.10-27 kg =
1,007276 uma
Masse atomique : Voir Classification périodique des éléments.
Masse volumique ρ :
Solides (en kg/dm³, multiplier par 1000 pour avoir des kg/m³) à 20°C
aluminium |
2,7 |
fer et aciers |
7,3 à 7,9 |
cuivre |
8,9 |
argent |
10,5 |
Plomb |
11,3 |
or |
19,3 |
Platine |
21,5 |
verre |
2,5 à 2,6 |
soufre |
1,96 |
calcaire |
2 à 2,5 |
marbre |
2,5 à 2,7 |
houille |
1,33 à 1,4 |
bois sec |
0,5 à 0,8 |
liège |
0,24 à 0,3 |
glace 0°C |
0,917 |
Chrome |
7,1 |
étain |
7,3 |
magnésium |
1,7 |
Nickel |
8,9 |
Potassium |
0,86 |
Sodium |
0,97 |
Tungstène |
19,3 |
Uranium |
18,7 |
Zinc |
7,1 |
Silice Fondue |
2,7 |
Chlorure de sodium |
2,16 |
|
|
|
|
Liquides (en kg/dm³) à 20°C
eau pure 4°C |
1 |
eau pure 15°C |
0,999 |
essence super |
0,730 - 0,780 |
essence ordinaire |
0,715 - 0,765 |
eau de mer |
1,026 |
alcool |
0,79 |
Benzène |
0,88 |
huile d'arachide |
0,92 |
Lait de vache |
1,03 |
Mercure |
13,6 |
acétone |
0,79 |
Chloroforme |
1,5 |
Éther |
0,71 |
Glycérine |
1,26 |
Sulfure de carbone |
1,26 |
Gaz (en kg/dm³, aux conditions normales)
air |
1,293.10-3 |
azote N2 |
1,25.10-3 |
Hydrogène H2 |
0,0899.10-3 |
oxygène O2 |
1,43.10-3 |
Hélium He |
0,179.10-3 |
Chlore Cl2 |
3,21.10-3 |
Dioxyde de soufre SO2 |
2,93.10-3 |
Dioxyde de cabone CO2 |
2.10-3 |
Ammoniac NH3 |
0,77.10-3 |
Vapeur d'eau à 100°C |
0,6.10-3 |
|
|
|
|
molaire des gaz (constante) : R = 8.314510 J / (K.mol)
Neutrinos :
Quelques énergies libérées relatives aux interactions des neutrinos avec la
matière :
réaction |
seuil de réaction (en MeV) |
νe e -> νe e (avec D2O) |
7,3 |
νe + 37Cl -> e- + 37Ar |
0,8 |
νe71Ga -> e+ + 71Ge |
0,233 |
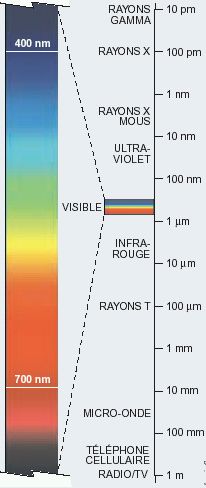
Ondes électromagnétiques :
Des longueurs d'ondes les plus courtes (fréquences les plus hautes donc
énergie les plus grandes) aux longueurs d'ondes les plus grandes (énergie
min) :
Rayons gamma (10 pm) - Rayons X (100 pm) - entre 1 nm et 10 nm, les rayons X
mous - entre 10 et 100 nm, les UV - entre 400 nm (violet) et 700 nm (rouge) le
spectre visible de la lumière - entre 1 μm et 10
μm les infra-rouges - Rayons T (100 μm) - micro-ondes entre 10 mm et 100 mm - entre 100 mm et
1m, les ondes des téléphones cellulaires - 1 m les ondes radio et TV
Paramètres de fonctionnement moteur :
* Pression dans le cylindre : PMH fin de compression : 15 bars (essence) ou 30
bars (diesel); max de combustion : 80 bars (essence) à 100 bars (diesel hautes
performances), et 180 bars si cliquetis.
* Pressions d'injection de carburant : 1bar (essence monopoint, amont
papillon), 3 bars (essence multipoint, pour une meilleure pulvérisation), 100
à 125 bars (diesel)
* Températures dans le cylindre : fin de compression : ; max de combustion :
2500°C dans le mélange et 150 à 200°C sur les parois (pour ne pas dégrader
les propriétés physico-chimiques de l'huile elles sont refroidies); début
échappement : supérieure à 800°C, suivant le fonctionnement (température
inférieure si on augmente l'avance, et supérieure si on diminue l'avance à
l'allumage) ;
* Pertes diverses dans le moteur : rendement de -15% pour les échanges de
températures dans le radiateur et les ailettes de refroidissement, de -5% pour
le rayonnement du carter chaud, de -15% par frottements divers; 40% de
l'énergie de l'explosion part dans l'échappement;
Particules élémentaires : Il y en a
12.
- Quarks : Il y a 6 sortes de quarks, définis par une
saveur particulière (up, down, etc.) :
up (le "u") : charge: +2/3 . masse: 5 millions
eV
down (le "d"): charge: -1/3 . masse: 10 millions eV
charmé (le "c"): charge: +2/3 . masse: 1,5
milliards eV
étrange (le "s" pour strange): charge: -1/3 . masse: 200 millions
eV
top (le "t"): charge: +2/3 .
masse: 180 milliards eV
beauté (le "b"): charge: -1/3 . masse: 4,7 milliards eV
-
Leptons : Comme la famille des quarks, il y en a 6.
électron : charge: -1 . masse: 500 000 eV
neutrino-électron : charge: 0 . masse: < 2,8 eV
muon : charge: -1 . masse: 100 millions eV
neutrino-muon : charge: 0 . masse: < 2,8 eV?
tau : charge: -1 . masse: 1,8 milliard eV
neutrino-tau : charge: 0 . masse: < 2,8 eV
PCI : (voir Pouvoir Calorifique Inférieur)
Pi (π) : 3.14 15 92 653 589
793 238 462 643 383 279 502 884 197 169
C'est le nombre de radians (adimensionnels) que l'on à dans 90° (unité
adimensionnelle aussi), représentant l'angle droit.
Planck (constante de) : h=6,626 075 5.10-34 J.s
Potentiel d'ionisation :
H -> H+ : valeur élevée (1,309568 MJ/mol, soit 13,6 eV).
Potentiels standards de réduction d'électrode en solution aqueuse :
Ces données sont mesurées à partir de l'électrode normale à
hydrogène (ENH) prise comme référence à 0V/ENH. Les conditions standards
sont une température à 25°C (298 K), pression d'hydrogène arrivant
sur l'électrode à 1 bar (105 Pa) et un pH=0 pour
la solution (milieu acide, avec une concentration de
H3O+ de 1 mole/l). La concentration des espèces
dissoutes de l'électrode est elle aussi de 1 mole/l.
Seul le potentiel de la demi réaction de réduction est noté, en V/ENH (voir cours de technologies électrochimiques).
Le potentiel de la demie réaction d'oxydation est de signe contraire. Ainsi,
les réactions dont le potentiel est négatif indiquent que c'est la
réaction d'oxydation qui se produira spontanément. Le tableau va des
réducteurs les plus puissants (potentiel le plus négatif) aux oxydants les
plus puissants (potentiels positifs les plus élevés).
Abréviations utilisées pour les états: aq = aqueux, s = solide, l =
liquide, g = gazeux
Li+(aq) + e- ⇌ Li(s) |
-3,04 |
Cu+(aq) + e- ⇌ Cu(s) |
0,52 |
K+(aq) + e- ⇌ K(s) |
-2,92 |
I2(s) + 2e- ⇌ 2I-(aq) |
0,54 |
Ca2+(aq) + 2e- ⇌ Ca(s) |
-2,76 |
ClO2-(aq) + H2O(l) + 2e- ⇌ ClO-(aq)+ 2OH-(aq) |
0,59 |
Na+(aq) + e- ⇌ Na(s) |
-2,71 |
Fe3+(aq) + e- ⇌ Fe2+(aq) |
0,77 |
Mg2+(aq) + 2e- ⇌ Mg(s) |
-2,38 |
Hg22+(aq) + 2e- ⇌ 2Hg(l) |
0,80 |
Al3+(aq) + 3e- ⇌ Al(s) |
-1,66 |
Ag+(aq) + e- ⇌ Ag(s) |
0,80 |
2H2O(l) + 2e- ⇌ H2(g) + 2OH-(aq) |
-0,83 |
Hg2+(aq) + 2e- ⇌ Hg(l) |
0,85 |
Zn2+(aq) + 2e- ⇌ Zn(s) |
-0,763 |
ClO-(aq) + H2O(l) + 2e- ⇌ Cl-(aq)+ 2OH-(aq) |
0,90 |
Cr3+(aq) + 3e- ⇌ Cr(s) |
-0,74 |
2Hg2+(aq) + 2e- ⇌ Hg22+(aq) |
0,90 |
Fe2+(aq) + 2e- ⇌ Fe(s) |
-0,41 |
NO3-(aq) + 4H+(aq) + 3e- ⇌ NO(g) + 2H2O(l) |
0,96 |
Cd2+(aq) + 2e- ⇌ Cd(s) |
-0,40 |
Br2(l) + 2e- ⇌ 2Br-(aq) |
1,07 |
Ni2+(aq) + 2e- ⇌ Ni(s) |
-0,23 |
O2(g) + 4H+(aq) + 4e- ⇌ 2H2O(l) |
1,23 |
Sn2+(aq) + 2e- ⇌ Sn(s) |
-0,14 |
Cr2O72-(aq) + 14H+(aq) + 6e- ⇌ 2Cr3+(aq) + 7H2O(l) |
1,33 |
Pb2+(aq) + 2e- ⇌ Pb(s) |
-0,13 |
Cl2(g) + 2e- ⇌ 2Cl-(aq) |
1,36 |
Fe3+(aq) + 3e- ⇌ Fe(s) |
-0,04 |
Ce4+(aq) + e- ⇌ Ce3+(aq) |
1,44 |
2H+(aq) + 2e- ⇌ H2(g) |
0,00 |
MnO4-(aq) + 8H+(aq) + 5e- ⇌ Mn2+(aq) + 4H2O(l) |
1,49 |
Sn4+(aq) + 4e- ⇌ Sn2+(aq) |
0,15 |
Au+(aq) + e- ⇌ Au(s) |
1,60 |
Cu2+(aq) + e- ⇌ Cu+(aq) |
0,16 |
H2O2(aq) + 2H+(aq) + 2e- ⇌ 2H2O(l) |
1,78 |
ClO4-(aq) + H2O(l) + 2e- ⇌ ClO3-(aq)+ 2OH-(aq) |
0,17 |
Co3+(aq) + e- ⇌ Co2+(aq) |
1,82 |
AgCl(s) + e- ⇌ Ag(s) + Cl-(aq) |
0,22 |
S2O82-(aq) + 2e- ⇌ 2SO42-(aq) |
2,01 |
Cu2+(aq) + 2e- ⇌ Cu(s) |
0,34 |
O3(g) + 2H+(aq) + 2e- ⇌ O2(g) + H2O(l) |
2,07 |
ClO3-(aq) + H2O(l) + 2e- ⇌ ClO2-(aq)+ 2OH-(aq) |
0,35 |
F2(g) + 2e- ⇌ 2F-(aq) |
2,87 |
IO-(aq) + H2O(l) + 2e- ⇌ I-(aq)+ 2OH-(aq) |
0,49 |
|
|
Pouvoir Calorifique Inférieur (PCI) :
Quantité de chaleur dégagée par la combustion d'un gaz ou d'un combustible liquide, en tenant compte du fait que la vaporisation de l'eau (issue de la combustion) absorbe de l'énergie (en J). Voici le PCI de quelques carburants usuels, en MJ/kg :
Combustibles pétroliers |
Autres combustibles |
Combustibles gazeux |
essence : 43,9 |
méthanol : 19,85 |
hydrogène H2 : 120 |
A noter que si le carburant est préalablement vaporisé, l'énergie dégagée est plus forte, la combustion n'ayant pas à fournir l'énergie pour vaporiser la carburant. Pour les hydrocarbures, ce gain reste modéré, puisque leur enthalpie massique de vaporisation, comprise entre 300 et 500 kJ/kg, ne représente qu'environ 0.8 à 1% du PCI. Pour les alcools, l'enthalpie massique de vaporisation à 25°C (1100kJ/kg pour le méthanol par exemple) atteint 5.5% de son PCI à l'état liquide.
Pouvoir Calorifique Supérieur (PCS) :
Quantité totale de chaleur dégagée par un gaz ou un combustible liquide
en brûlant. Ne s'applique pas aux produits dont l'eau est un produit de la
combustion, car l'énergie de cette dernière n'est pas récupérée en
général (sauf pour les chaudières à condensation qui récupèrent la
chaleur contenue dans l'eau vapeur issue de la combustion, ce qui permet
d'afficher 120% de rendement, s'entendant sur le PCI, mais inférieur à 100%
si on prends le PCS).
Les 2cv récupèrent la chaleur de l'échappement en condensant pas mal
d'eau, ce qui explique le chauffage très efficace et des échappements
durant difficilement plus de 4 ans.
Pouvoir Calorifique Utile : (voir Pouvoir Calorifique Inférieur)
Rendements :
rendements de différents types de moteurs :
essence 2 temps : 16 - 18 %
essence 4 temps : 20- 30 %
Diesel atmo : 25- 33%
Diesel turbo : 30- 40 %
Turbomoteurs : 25 - 35 %
rendement mécanique moteur essence : 85 - 93 % ; moteurs diesel : 80 - 88 %
rendements thermique ([Q1-Q2]/Q2, Q1 chaleur (kJ) dégagée par
l'explosion, Q2 chaleur perdue aux parois et dans les gaz d'échappement) de
différents types de moteurs :
essence 2 temps : 18 - 20 %
essence 4 temps : 22 - 30 %
essence 4 T turbo : 30 - 40 %
Diesel atmo (voiture légère) : 25 - 32 %
Diesel atmo (camion) : 26 - 33 %
Tableau périodique : Voir Classification périodique des éléments
Taille des atomes : Atome d'Hydrogène 2.34 Å, et atome d'Oxygène 2.92 Å. L'hydrogène fait 80% de l'atome d'oxygène.
Températures :
Les corps émettent une lumière quand ils sont chauffés (commencent à
devenir lumineux vers 500 °C, la lumière augmentant d'intensité avec la
température), dont la couleur dépend de la température :
- rouge sombre (de 500 °C à 700 °C)
- rouge vif (de 900°C à 1 000 °C)
- rouge blanc (de 1 200 °C à 1 500 °C)
Quelques températures usuelles :
- filament tungstène d'une lampe à incandescence : 2 600 °C
- Soleil : 6 000 °C
Dans un moteur à explosion :
- température d'explosion : 2 600 °C
- température des gaz d'échappement : 800 °C
Températures de quelques corps, en °C, ainsi que quelques grandeurs calorimétriques :
Solides
|
Coef de dilatation linéaire (x10-6) |
Chaleur massique |
Température de fusion °C |
Chaleur de fusion |
aluminium |
23 |
0,22 |
660 |
94 |
argent |
19 |
0.056 |
960 |
25 |
Chrome |
6,5 |
0.11 |
1800 |
76 |
cuivre |
16 |
0.092 |
1083 |
49 |
étain |
22 |
0.054 |
232 |
14 |
fer |
12 |
0.11 |
1530 |
64 |
magnésium |
25 |
0.25 |
651 |
89 |
Nickel |
13 |
0.11 |
1455 |
72 |
or |
14 |
0.031 |
1063 |
16 |
Platine |
9 |
0.032 |
1755 |
24 |
Plomb |
29 |
0.031 |
327 |
6 |
Potassium |
83 |
0.18 |
63.6 |
15 |
Sodium |
72 |
0.30 |
98 |
27 |
Tungstène |
4 |
0.032 |
3650 |
46 |
Uranium |
|
0.028 |
1850 |
|
Zinc |
36 |
0.092 |
420 |
24 |
Chlorure de sodium |
|
0.21 |
801 |
124 |
glace 0°C |
50 |
0.5 |
0 |
80 |
liège |
|
0.4 |
|
|
marbre |
|
|
|
|
Silice fondue |
0,52 |
0.26 |
1625 |
|
soufre |
64 |
0.18 |
113 |
9,3 |
verre |
8 |
0.19 |
|
|
Liquides
|
Coef de dilatation absolu (x10-3) |
Chaleur massique |
Température de solidification °C |
Température d'ébullition normale °C |
Chaleur de vaporisation |
acétone |
1.4 |
0.52 |
-95 |
56 |
125 |
alcool |
1.1 |
0.56 |
-114 |
78 |
202 |
Benzène |
1.1 |
0.41 |
5.5 |
80 |
94 |
Chloroforme |
1.3 |
0.23 |
-63.5 |
61 |
59 |
eau |
|
1 |
0 |
100 |
540 |
Ether |
1.6 |
0.55 |
-120 |
35 |
86 |
Glycérine |
0.5 |
0.39 |
18 |
290 |
|
Mercure |
0.18 |
0.033 |
-39 |
357 |
70 |
Sulfure de carbone |
1.2 |
0.24 |
-112 |
45 |
84 |
Gaz
|
Température de cristallisation °C |
Température d'ébullition normale °C |
Température critique °C |
Ammoniac NH3 |
-78 |
-33 |
132 |
oxygène O2 |
-79 |
sublimation |
31 |
Dioxyde de soufre SO2 |
-76 |
-10 |
157 |
Dioxyde de carbone CO2 |
-210 |
-196 |
-147 |
azote N2 |
-101 |
-34 |
144 |
Chlore Cl2 |
-271 |
-269 |
-268 |
Hélium He |
-259 |
-253 |
-240 |
Hydrogène H2 |
-219 |
-183 |
-119 |
Temps : Quelques notions de temps : rupture d'une liaison moléculaire : 1 picoseconde (10-12s); saut d'un électron entre 2 atomes : 1 femtoseconde (10-15s); dans un atome, saut d'un électron d'un niveau d'énergie à l'autre : 1 attoseconde (10-18s)
1 uma = 1.6604.10-27 kg
Vitesse des molécules : Pour le dihydrogène gazeux H2, la vitesse moyenne est de 1 700 m/s, soit 109 chocs par seconde en moyenne, à 0°C. Quand la température augmente, cette vitesse augmente.
1 W.h = 3,6.103 m².kg / s² = 3,6.103 J = 3,6
kJ
1 kW.h = 3,6.106 m².kg / s² = 3,6.106 J = 3600
kJ
à suivre...