Nature Humaine (amocalypse)
Théorie>Propriétés de l'eau>Caractéristiques
thermodynamiques
Première version: 31/08/2002
Dernière version: 2015-05-07
Propriétés de l'eau (3/8)
Caractéristiques Thermodynamiques
Sommaire de la page
Vocabulaire utilisé
propergol = carburant hydrogène H2 et comburant oxygène O2
Symboles : - signifie une liaison covalente, ... une liaison hydrogène.
Calorimétrie - Changements de phase
Présentation
L'eau est un des seuls corps qui soit nommée différemment selon la phase
ou elle se trouve. La molécule H2O est donc appelée glace quand
elle se trouve à l'état solide, est appelée eau quand elle est à l'état
liquide, et vapeur d'eau à l'état gazeux.
La différence entre ces trois phases est la configuration moléculaire de
l'eau. A l'état gazeux, il n'y a plus aucune interaction entre les molécules
d'eau, s'agitant librement et sans contrainte. Cela provient de la grande
énergie des molécule, liée à la température, qui empêche les molécules
d'eau, bipolaire (l'atome d'oxygène étant le pôle négatif et les atomes
d'hydrogène le pôle positif), d'exercer des attractions les unes sur les
autres.
Quand la température s'abaisse, ou que les molécules se rapprochent les unes
des autres (augmentation de pression), ces pôles positifs et négatifs vont
s'attirer, et l'énergie des molécules n'est plus assez élevée (ou la
distance entre molécule plus assez grande) pour contrer cette force (c'est la
force électrostatique s'établissant entre 2 charges, cette force étant aussi
appelée force coulombienne, voir le chapitre d'électrostatique qui introduit
la notion d'électricité).
Quand la force coulombienne devient supérieure à l'énergie cinétique de la
molécule, les molécules d'eau se lient entre elles, c'est les liaisons
hydrogène. Les molécules ne peuvent plus se séparer, mais uniquement glisser
les unes sur les autres. Le corps est alors un fluide, le gaz s'est ainsi
transformé en liquide. C'est ce qu'on appelle l'eau.
Les molécules les plus énergétiques se retrouvent alors à la surface du
liquide, et par contact avec l'air, se vaporise constamment alors qu'une petite
partie des molécules gazeuses de vapeur d'eau, contre la surface de l'eau (les
moins énergétiques de la vapeur d'eau) se condensent en eau. Si la pression
est faible, l'évaporation de l'eau sera très élevée, de même que si on
augmente la température de l'eau, que l'on augmente la surface de contact, et
que l'atmosphère est moins saturée en vapeur d'eau. Il faut bien comprendre
qu'une partie de l'eau en surface se vaporise en vapeur d'eau, en même temps
qu'une partie de la vapeur d'eau se condense en eau. Ces deux mouvements
contraire se produise tout le temps. Suivant les conditions, le flux de
molécules vaporisées sera plus important que celui des molécules qui se
recondense, le liquide diminue de volume, ou c'est le contraire qui se produit,
et le liquide gagne en volume.
Nous avons donc vu que dans la vapeur d'eau, il n'y a pas de forces qui
lient les molécules entre elles, ces dernières sont donc libres, c'est un
gaz.
Dans l'eau, les liaisons hydrogène contraignent les molécules à restées
collées entre elles, mais pas à se déplacer. C'est un liquide.
Quand on descend encore la température, se crées de nouvelles liaisons entre
les molécules, en plus de liaisons hydrogène, ce sont les liaisons de Van der
Waals, liaisons faibles, mais qui suffisent à bloquer le mouvement des
molécules relativement aux autres. C'est la glace, qui est un solide.
Changements d'état : Les changements d'état se font à température
constante (diagramme de Mollier) 0°C pour la solidification et 100°C pour la
vaporisation. Le volume est multiplié par ??? lorsque l'eau liquide passe à
l'état vapeur (utilisation de cette caractéristique dans les machines à
vapeur).
L'eau est beaucoup utilisée dans les machines à vapeur (comme les centrales
électriques) pour ses changements de phase.
Diagramme des changements de phase de l'eau
Lors d'un changement d'état, la température reste constante à l'échelle
macroscopique (c'est ce qu'on appelle la transition de phase). A ce moment-là,
l'eau absorbe beaucoup plus de chaleur pour monter d'un degré (soit voir toute
l'eau passer d'un état à l'autre) qu'elle n'en a absorbé pour monter sa
température de 100 °.
A l'échelle des atomes, la température n'est pas constante. Prenons l'exemple
de la fusion (transformation de la glace en eau liquide). La température d'une
molécule d'eau est -5°C, l'on fournit de l'énergie, donc la température
croît régulièrement depuis -5°C à 0°C, puis elle retombe alors que l'on
continue à injecter de l'énergie. Pourquoi?
En fait, la molécule à commencer à casser certaines de ses liaisons avec ses
voisines (ici, les liaisons de Van der Waals), elle se retrouve alors dans un
état instable mi-solide mi-liquide, qu'elle doit quitter au plus vite. Elle
convertit alors une partie de son énergie thermique en énergie potentielle,
cette énergie potentielle étant utiliser pour casser le reste des liaisons,
et accélérer ainsi le passage à l'état liquide. Comme une partie de son
énergie thermique est convertie, la molécule diminue en température (la
température étant une grandeur caractérisant l'agitation de la molécule,
dans un gaz cette agitation étant un mouvement et dans un solide, une
oscillation de la molécule sur elle-même). Voilà pourquoi la température
baisse un bref instant alors que l'énergie interne continue de croître.
Pour un glaçon, comme il y a énormément de molécule, on ne voit pas cette
chute de température. Seule une infime partie des molécules se trouve à
l'interface solide-liquide, la baisse de température est imperceptible à
notre échelle, on voit donc une température constante de 0°C tout le long de
la fusion.
Explication des particularités de l'eau par analyse des molécules
Les molécules d'eau à l'état liquide sont liées entre elles par les
liaisons hydrogène, 50 fois moins fortes que les liaisons covalentes de la
molécule d'eau (10kJ par mole). Ces liaisons hydrogènes apparaissent et
disparaissent au rythme de 1012 fois par seconde, rompues par
l'agitation thermique.
Dans la liaison hydrogène, seul un atome (l'O) fournit les deux électrons de
la liaison hydrogène. Comme l'O possède deux doublets électroniques, il peut
s'engager dans deux liaisons hydrogène, en plus des deux liaisons covalentes
de la molécule d'eau.
- Pour une molécule dont l'écartement entre les deux atomes de H est de
104°, la distance O-H est de 0,1 nm. La distance H et O via la liaison
hydrogène est presque le double, soit 0,18 nm. Cette distance étant fixe,
elle empêche les molécules de se rapprocher. Comme l'atome d'hydrogène est
très léger, s'il s'écarte de plus de 30° de l'axe entre les deux atomes
d'oxygènes (relié à un par liaison covalente, à l'autre par liaison
hydrogène), la liaison est cassée (la distance augmente donc diminue la force
de la liaison, qui à température ambiante est 4 à 5 fois plus forte que
l'agitation moléculaire, ce qui explique qu'a température ambiante l'eau soit
liquide et non solide).
- Dans la glace, le réseau est cristallin et hexagonal. Dans l'eau liquide,
les liaisons hydrogènes sont moins nombreuses, ce réseau est désordonné,
mais il reste quelques poches hexagonales. Les molécules d'eau ont plus de
degrés de liberté pour absorber de l'énergie (donc chaleur spécifique plus
élevée pour le liquide que pour la glace).
Voici par exemple l'organisation tétraédrique de la glace. En trait fort les liaisons covalentes O-H, en tirets les liaisons hydrogène, et en trait fins le tétraèdre formé par l'agencement des molécules. En rouge l'atome de O, en bleu l'atome de H.
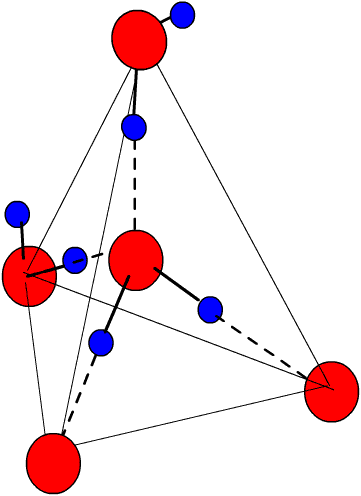
La molécule au centre est éloignée de ses quatre voisine par la distance
de 0,28 nm.
Ainsi, quand la glace fond, une certaine partie des liaisons hydrogène est
rompue, les molécules peuvent se rapprocher les unes des autres, ce qui
explique que la densité de l'eau est maximale à l'état liquide, pour la
température de 4°C. Ensuite, c'est l'agitation thermique qui devient
prépondérante et tend à éloigner les molécules l'une de l'autre, donc à
diminuer la densité plus l'on chauffe.
La durée de vie d'une liaison hydrogène n'excède pas une picoseconde.
La liaison hydrogène s'aligne dans l'axe de la liaison de valence qui lui est associée (ex : O-H...O sont alignés).
L'énergie de formation d'une liaison hydrogène est de l'ordre de grandeur de celles mises en jeu à la température ambiante de 25°C, ce qui lui permet de se faire et se défaire sans arrêt.
La liaison hydrogène à ceci de remarquable qu'elle permet le passage d'un ion H+ entre les molécules liées par la liaison hydrogène (celle-ci serait spécifique pour permettre un tel transfert).
Lorsque la température diminue, les liaisons hydrogène qui pouvaient se tordre (sous l'effet de l'agitation thermique des molécules) tendent à devenir rectilignes.
A noter que dans la communauté scientifique deux écoles s'affrontent sur les liaisons hydrogènes de l'eau liquide pour expliquer sa fluidité. Certains pensent que les liaisons sont permanentes et se tordent, pour permettre l'agitation thermique des molécules, d'autres pensent que les liaisons se font et se défont sans cesse à très grande vitesse, et il faut alors prendre en compte le nombre total de liaisons présentes au même instant pour en faire une moyenne.
Page suivante : Caractéristiques Chimiques de l'eau
Page précédente : Caractéristiques
mécaniques de l'eau
à suivre...