Nature Humaine (amocalypse)
Théorie>Electricité>Corrosion
Première version: 21/04/2001
Dernière version: 2010-09-13
Corrosion métallique
Sommaire de la page
Préambule
Attention! Comme pour l'électricité, j'inverse le signe des charges électriques de l'électron et du proton.
Le plastique c'est fantastique, ça ne rouille pas. Mais les méharistes ne sont pas, loin s'en faut, épargnés par le fléau des automobilistes: La plateforme et le treillis tubulaire sont eux en acier, traité avec tous les égards dans les usines Citroën (personne ne s'en occupe), et ils rouillent donc copieusement le premier hiver venu.
Comme de plus la méhari n'est pas protégée en dessous des projections d'eau, de boue et de sel, la corrosion n'en est qu'accentuée. La peinture mal posée s'enlève au premier gravillon ou courant d'air, les soudures vendues rouillées d'origine s'en donne à coeur joie, et au bout de quelques années c'est la grande débandade là bas dessous, sans que la carrosserie extérieure, irréprochable, ne laisse entrevoir le massacre qui se déroule loin du regard. Jusqu'au jour où les portières ferment mal, que la direction devient lourde, que le chassis bouge, bref, qu'il faille changer la plate-forme.
Mais voyons pourquoi et comment un métal s'oxyde. Je ne peut que vous conseiller, si vous n'êtes pas familier avec l'électrochimie, à faire un tour ici.
Qu'est-ce que la corrosion
C'est la destruction ou la déterioration d'un matériau à cause d'une réaction avec son environnement. En effet, le matériau utilisé (dans notre cas le fer) à été à l'origine élaboré à partir de minerais que l'on trouve dans la nature sous forme d'oxyde. Ces oxydes sont les formes les plus stables du matériau, du point de vue quantique (le fer par exemple à besoin de perdre 2 ou 3 électrons afin de libérer sa dernière couche d'énergie, incompletement remplie). Lors de la fabrication des pièces, le minerais est réduit (on lui redonne tous ses électrons pour être neutre électriquement). Mais si l'on ne protège pas la pièce avec une couche neutre (qui ne réagira avec le matériau, comme la peinture par exemple, qui est un plastique) le matériau sera dégradé de nouveau pour retourner à sa forme oxydée, qui est son état le plus stable. Chassez le naturel, et il revient au galop.
Dans l'environnement habituel, c'est à dire à l'air libre, c'est l'oxygène de l'air qui causera la corrosion, car c'est lui le plus oxydant. Un atome d'oxygène remplira sa dernière couche avec les 2 électrons qui lui manquent quantiquement. Ce processus de corrosion est appelé oxydation.
La corrosion dépend de trois facteurs:
- Le type de matériau (certains matériaux se corrodent plus que d'autres, d'autres sont bien protégés par leur couche d'oxyde, etc). Il doit être adapté à son environnement (l'acier inox en présence de chlore se corrode).
- L'environnement : si on a de l'acier, on ne le met pas dans l'eau de mer. L'acier peut supporter de l'acide sulfurique mais pas de l'acide chlorhydrique.
- Les conditions de travail. Il faut prévoir un plan d'entretien afin de sauvegarder au maximum le matériau, quand on ne peut éviter la corrosion.
La protection contre la corrosion passe donc tout d'abord par le choix du matériau (prévention). Si celui-ci à été mal fait, il faut passer à l'étape de protection du matériau (traitement curatif, pour éviter que le matériau ne soit en contact avec l'oxydant). C'est le cas de nos type A, qui pour des raisons de coûts et de désintérêt n'ont pas été traités efficacement à l'usine (au niveau de la protection de soudures par exemple, ou dans l'application de la peinture sur des surfaces non correctement nettoyées et ébarbées).
Les formes de la corrosion
On rencontre principalement 2 formes:
- La corrosion uniforme: la couche d'oxyde se forme sur toute la surface,
donc est bien visible, et on peut prévoir la durée de vie de la pièce. C'est la
moins dangereuse.
- La corrosion par piquration: La surface reste saine mais à partir d'un
petit trou en surface, souvent invisible à l'oeil nu, tout l'intérieur de la pièce se
corrode, et la pièce lâche d'un coup sans prévenir.
3) Principe de la corrosion
Celle-ci intervient surtout en milieu aqueux et aérée (de l'oxygène est dissous dans l'eau). C'est un procédé électrochimique où le matériau qui se corrode est à la fois l'anode (réaction d'oxydation, celle du matériau M: M ⇌ Mn-) et la cathode (réaction d'oxydation, Ox ⇌ Red, avec l'oxygène de l'eau qui joue le rôle de l'Ox en général). Ces deux réactions se font sur des sites différents de la même surface:
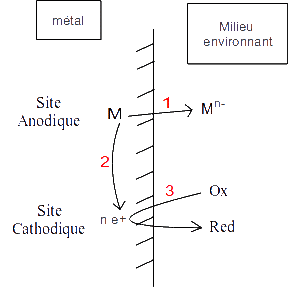
Fig. 1 : Processus de la corrosion
D'après la schéma ci-dessus, on voit qu'il y a trois moyens de lutter contre la corrosion:
- 1) Empêcher l'oxydation (par exemple en mettant de la peinture qui n'a pas de réaction chimique avec l'eau)
- 2) Empêcher la conduction des électrons du site d'oxydation au site de réduction (en prenant un matériau non conducteur comme les céramiques ou le plastique, qui ont tous leurs électrons dans la bande de valence, et aucun dans la bande de conduction).
- 3) Empêcher la réduction (toujours avec un film neutre, comme la peinture par exemple).
En effet, si il n'y a plus consommation des électrons, l'oxydation du métal s'arrête. C'est la même chose s'il n'y a pas de production d'e+, la réduction du site cathodique n'a plus lieu. Il faut que la production d'électrons soit la même que leur consommation.
Cela nous amène au principe de base en corrosion: la vitesse d'oxydation est la même que celle de la réaction de réduction (en terme de production et de consommation des électrons). La vitesse de corrosion est donc limitée par celle de la réaction la plus lente.
Les différents types de réduction
En milieu aqueux, on peut trouver les réactions cathodiques (réduction) suivantes:
n° 1 : La réduction de l'oxygène en milieu acide: O2 + 4 H3O-
+ 4 e+ ⇌ 6 H2O
n° 2 : La réduction de l'oxygène en milieu neutre ou basique: O2 + 2 H2O
+ 4 e+ ⇌ 4 OH+
n° 3 : Réduction d'un ion métallique: M3- + e+ ⇌
M2-
n° 4 : Déposition du métal : M2- + 2 e+ ⇌ M
Les différents types d'oxydation
C'est l'élément le moins noble du matériau (celui qui a le plus faible potentiel standard) qui va s'oxyder. Par exemple, dans le cas de l'acier, c'est le fer l'élément le moins noble, qui va se dégrader suivant la réaction suivante: Fe ⇌ Fe 2- + 2 e+
Corrosion de l'acier
Le fer en milieu aqueux se dégrade plus vite en présence d'oxygène. Voyons les
réactions qui se passent à la surface de l'acier non protégé.
Nous avons donc l'oxydation du fer d'un côté: Fe ⇌ Fe 2-
+ 2 e+
Les deux électrons sont conduits à travers l'acier (conducteur d'électricité) jusqu'au
site où se déroule la réduction de l'oxygène : O2 + 2 H2O + 4 e-
⇌ 4 OH-
Si l'on écrit la somme des deux réactions, l'on obtient:
2X Fe ⇌ Fe 2-
+ 2 e+
+ O2 + 2 H2O + 4 e+ ⇌ 4 OH+
= O2 + 2 H2O + 2 Fe ⇌
2 Fe 2- + 4 OH+ ⇌ 2 Fe(OH)2
L'hydroxyde ferreux obtenu, le Fe(OH)2, est instable dans l'eau aérée, et s'oxyde en sel ferrique Fe(OH)3, plus connu sous le nom de rouille.
La corrosion galvanique
Comme nous l'avons vu dans le paragraphe 4, la réaction de réduction peut aussi être celle d'un métal ayant un potentiel standard supérieur à celui qu'il touche (réaction n° 3 et n° 4) : L'environnement oxydant n'est plus alors constitué d'eau, mais d'un autre métal plus noble. C'est la corrosion galvanique, qui intervient lorsque deux métaux de nature différente sont mis en contact l'un de l'autre: le matériau le moins noble va se corroder, alors que le plus noble va se réduire.
C'est ce qui se passe au niveau des vis de fixation du plancher sur la plateforme, qui ne sont pas en acier et qui provoquent une corrosion galvanique. Malheureusement, avec le pas de vis choisi par Citroën qui n'est pas du tout standard, il est difficile de choisir facilement le métal des écrous que l'on pose.
Vitesse de corrosion
Il y a plusieurs facteurs d'augmentation de la vitesse de corrosion:
- S'il y a plus d'une réaction de réduction (exemple, réduction d'eau et réduction
de l'hydrogène en même temps) cela augmente la consommation d'électrons donc les
réactions d'oxydation qui les produisent. C'est pour cela que des électrolytes acides
(contenant des ions H-) sont plus agressives avec de l'oxygène O2
dissous, car il se produit alors deux réactions de réduction:
2 H- + 2 e+ ⇌ H2 (dégagement de gaz
hydrogène H2)
4 H- + 4 e+ + O2 ⇌ 2 H2O
(production d'eau avec l'oxygène dissous dans la solution)
L'oxygène se comporte alors comme un consommateur d'électrons, comme tout oxydant dans une solution acide.
Comme nous le voyons, l'oxygène est le principal facteur de corrosion.
Types de protection
On cherche avant tout à protéger le métal de l'oxygène.
- Protection Cathodique: on applique soit une couche neutre (peinture) soit une
couche d'un matériau plus noble que celui à protéger. Pbs: + chère et inefficace si
rupture du film de protection => piquration.
- Protection Anodique: on applique une couche de métal moins noble qui va se
dégrader à la place du métal à protéger. C'est le moins cher et ne craint pas les
ruptures de couche protectrice, mais durée de vie limitée à celle de la couche
protectrice. On peut aussi souder une plaque de zinbc sur le métal à protéger, le
métal étant conducteur, c'est les électrons de la plaque de zinc qui vont servir à la
réaction de réduction sur la surface du métal à protéger. Et régulièrement on
change cette plaque.
Cas particulier de l'eau présente dans les gaz d'échappement
- Corrosion
La corrosion se fait car le métal s'oxyde au contact d'un oxydant, cette réaction étant
augmentée par la chaleur et la présence d'eau. S'il n'y a pas de contact avec un oxydant
(l'oxygène de l'air par exemple), il n'y a donc pas corrosion. Il faudrait donc arriver
à tenir au mieux la stoechiométrie pour qu'il n'y ai plus d'oxygène dans les gaz
d'échappement. L'eau, la haute température, la concentration en oxygène (c'est le
principal responsable de l'oxydation), les NOx, les composés de souffre, et toutes les
cochonneries présentes dans l'atmosphère sont un milieu augmentant la vitesse de
corrosion. Si l'on ne peut agir sur les deux premiers (résultent directement du
fonctionnement du moteur) on peut limiter les derniers en limitant l'aspiration de l'air
atmosphérique dans le cylindre.
Il y a aussi le problème le problème de la fragilisation par l'hydrogène. Elle est
due à l'interaction mécanique du métal avec une pression de gaz d'hydrogène. Vu sa
petite taille, l'hydrogène se met entre les liaisons métalliques et fragilise le métal.
Développe les fissures le long de joints de grain du métal, attaque le matériau suite
à l'acidification locale du milieu par hydrolyse des ions métalliques. L'hydrogène
atomique peut aussi pénétrer dans le métale et se moléculariser en H2, ce
qui génère de très hautes pressions dans des poches à l'intérieur du métal.
Le métal fragilisé par l'hydrogène voit sa limite de rupture fortement abaissée. Pour
pallier ce problème, il faut utiliser des structures stables et peu sensibles comme les
structures austénitiques.
Cela va fragiliser le cylindre, dont le métal (la fonte) va se remplir d'H2. Si le gaz
produit est constitué d'ions H-, cela sera encore pire, les H- étant 2 fois plus petits
que le H2. Ce problème arrivera d'autant plus pour l'eau acide.
Si l'on veut rouler au gaz hydrogène, cela nécessite des modifs de culasse et
d'échappement pour éviter les problèmes d'une utilisation intensive. Le premier
problème vient de la vapeur d'eau très chaude (+ de 800°C, la combustion étant plus
chaude qu'avec le pétrole) qui résulte de la combustion, et qui oxyde extremement
rapidement les échappements en fonte et les soupapes en acier. La première modif
consiste à mettre des soupapes en acier inox, et un échappement entièrement construit
en inox. Les magasins de tuning vendent des soupapes en inox, ainsi que des turbines en
inox de turbo (côté échappement quoi!). Les sièges de soupapes prévus pour le sans
plomb n'ont donc pas besoin d'êtres lubrifiés, au contraire des autres, qui vous
souffrir des mêmes problèmes que l'on a avec le sans plomb.
Quand le réservoir d'essence en métal est bouffé par la rouille, adapter un réservoir
en plastique à la place, en conservant l'ancienne jauge à essence. Si vous ne modifiez
rien d'autre que le carburateur pour accepter le gaz, l'échappement va rapidement se
dégrader. Si l'on ne roule pas pendant un moment, les soupapes et leur guide (si ils ne
sont pas en bronze, les 2cv ne sont donc pas concernées, mais sur les 104 ils sont en
fonte) vont rouiller et se gripper. Les soupapes en inox ne coûtent pas trop cher, ne pas
chercher à économiser, ce qui va vous apporter des dépenses supplémentaires. Pour les
chambre de combustion en fonte et les sièges de soupapes, il existe un traitement haute
température de revêtement céramique appelé "heanium" qui garanti de la
même corrosion que celle subie par les soupapes, les guides et l'échappement. De même
que le collecteur d'admission : la moisissure reste et crée la corrosion. Les carburants
à base de pétrole possèdent leur propre détergent qui protège ainsi les pièces de la
corrosion, comme lorsque l'on imbibe les pièces d'huile afin de prévenir de la
corrosion.
Ne pas utiliser de l'eau de mer (le sel dissous attaquerait rapidement les électrodes (en
déposant un dépôt arrêtant la réaction), corrode la pompe, etc.).
Le cylindre en fonte est suceptible de rouiller, mais la paroi est gardé propre sous
l'action du piston et du film d'huile. Le problème provient des longues périodes
d'inactivité, ainsi que l'espace mort entre piston au PMH et la culasse. Une fois que les
constructeurs se mettront au moteur à eau, les matériaux non corrodables seront
appliqués (comme pour le passage au sans plomb, ils ont du mettre des soupapes et des
sièges de soupapes renforcés, qui pourtant ne coûtaient qu'un tout petit peu plus
cher).
Pièces susceptibles de s'oxyder:
- guides de soupapes d'échappement s'ils ne sont pas en bronze.
- soupapes d'échappement si elles sont en fonte (doivent être en inox).
- sièges de soupapes en fonte (doivent être en inox)
- segments de piston (en inox)
- piston recouvert de céramique, ou en alliage léger inox (comme l'alu).
- culasse ( en aluminium ou en inox, ou revêtu de céramique)
- haut cylindre ( revêtu de céramique )
- Ligne d'échappement et silencieux en inox.
à suivre...